| Q162★硝酸に溶けた鉛を取り出してみようと思い、鉛電池の理論を応用して、+
-両方に鉛電極を使い、硝酸に13Vの電圧を5分かけて見ました。しかし、その結果逆に硝酸の中の鉛濃度が高くなってしまいました。硝酸中の鉛濃度 100mg/L、電圧をかけた後
180mg/L。やはり電解液は希硫酸でなければならないのでしょうか? +極では、図の(1)式の反応がおこり、鉛のイオンが溶け出します。 -極では、鉛イオンの濃度が100 mg/L と薄いので、図の(2)式の反応と(3)式の反応(鉛イオンの還元と水素イオンの還元)が同時におこります。 従って、鉛イオンが溶液に溶け出す量よりも、鉛イオンが溶液から取り去られて金属鉛になる量の方が少ないので、溶液中の鉛イオンの濃度が減少したのでしょう。 このことを確かめるためには、 1. 鉛電極の電流を流す前と流したあとでの重さを量って、溶液に溶けている鉛イオンの変化と比べてみる。 2. −極で水素の発生が起こっているかどうかを観察する。 のようなことを行うと良いでしょう。 また、硝酸の代わりに希硫酸を使うと、硫酸鉛が水にはほとんど溶けないので、溶液には鉛イオンがほとんど存在せず、図の(2)式の反応はほとんどおこらなくなります。 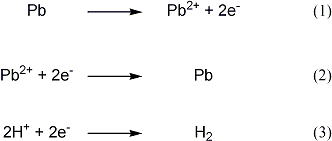 (MI) 2005/10/04 |
 |