| Q366★水素結合について質問があります。水とフッ化水素、それにアンモニアの沸点を考える際、電気陰性度の大きさ(FONの順)、分子量に比例するファンデルワールス力、そして水素結合の個数が鍵になると思います。
水素結合の個数についてなのですが、図の?のところがなぜ水素結合で他分子と結びつかないのか教えてください。 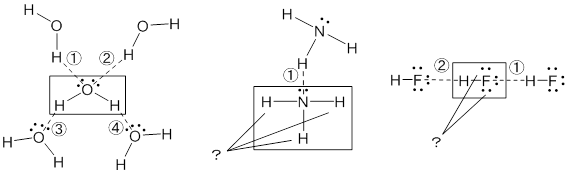 液体H2Oの1分子あたりの水素結合の数は4である一方、液体NH3と液体HFについては2、と言われています。これらの違いは、非共有電子対と水素原子の数のバランスで考えることができます。1分子のH2Oあたりの非共有電子対と水素原子の数は、いずれも2で非常にバランスが取れた状態です。一方、NH3分子およびHF分子ではそのバランスが崩れてしまうため(それぞれ、1:3と3:1)、水素結合の数に影響を与えていると考えられます。 具体的に、液体NH3中のあるNH3分子の水素結合を考えてみましょう。その分子の非共有電子対N:は隣接するNH3分子のHと水素結合を形成します。一方、その分子の3つのHのどれか1つは(時空間で平均すると1つ、という意味ですが)、他の隣接NH3分子のN:と水素結合を形成します。逆に言うと、2つのHは(平均的には)、水素結合に関与していません。 また、水素結合の形成には、非共有電子対の存在だけでなく、水素結合を形成する原子(OやF)が、どれだけ帯電しているか(部分電荷と言います)も重要になります。Fの方がOより電気陰性度は大きいですが、HF中のFの部分電荷(の絶対値)はH2O中のOの部分電荷(の絶対値)に比べて大きくはないので、水素結合の数は多くならないと考えられます。大まかな解釈として、H2OのO には2つのHが結合していますので、Oがその分より負に帯電していると考えても良いかと思います。 (SH & NN) 2018/06/1 |
 |