| Q360★冷却曲線に関する質問です。延長線を引いて本来の凝固点を求めるという記述を見かけるのですがよくわかりません。 何かしらの補正をかけていることのは理解できたのですが、なぜ延長線を引くことで本来の数値が求められるのかがわかりません。 溶媒にあたる水分子の凝固の核が必ずしも0℃でできないから過冷却が起こること、ギンギンに冷やし凝固が始まるとエネルギー(=凝固熱)が放出され温度が上昇するということまでは理解できています。 1)純溶媒(ただの水)の場合、凝固熱で曲線が温度上昇するのは理解できますが、なぜU字カーブを経たのち、都合よくその時点における凝固点の温度まで上がって止まるのかがわかりません。 2)不純物入り水溶液の場合、CDゾーンが斜めに下降していくのが理解できません。自分の中では溶媒が凝固したから、溶質の存在感が高まり、より一層残る溶媒の凝固が難しくなると思うのですが、なぜに綺麗に右下がりの「直線」になるのかわかりません。 3)この直線を延長すると、なぜ最初のU字型の凝固点降下のゾーンの補正ができるのかわかりません。 特に、過冷却のゾーンを二つに分けるすると、本来の凝固点より下がり続けているゾーン(Xとします)と、結晶核ができ凝固し始めた結果、グラフが上昇しているゾーン(Yとします)にわかれるとおもいます。 Xでも、一部の水分子が凝固し凝固熱が発生していると思いますし、凝固したものが融解して吸熱反応による冷却効果、そして外部から加えている冷却という、3つのパワーバランスがあってXという傾きになっているのだと思います。 Yになると、大きな結晶核ができて急速に凝固した結果、融解による冷却と外部からの冷却を打ち破るくらいの熱が発生しグラフが跳ね上がっているのだと思います。 そして平衡に至るわけですが、どうしてもいろんな熱が関わっているのに直線を延長して本来の凝固点を定められるということがうまく理解できません。 点Dが融解と凝固が釣り合った場所とも言えるので、凝固点と言えるのではないかとも思ったりしています。 まずは、純水(何も溶けていない水)について考えてみましょう。 さらに、ゆっくり冷却する場合と速く冷却する場合に分けて考えます。ゆっくり冷却する場合には平衡が成立していると思ってください。 液体の純水をゆっくり冷却していくと、0℃で固体の氷になり始めます(図の点A’)。そのまま冷却を続けても、しばらくは0℃のままです(図で点A’から点C’に進みます)。なぜなら、冷却により奪われる熱と、水が氷になることで発生する凝固熱が釣り合っているからです。その間、温度は0℃のままですが、水の割合がどんどん少なくなり、逆に、氷の割合はどんどん多くなります。ついに全部が氷になる(点D’)と、もう発生する凝固熱はありませんから、氷から熱が奪われ、温度が0℃以下に下がるようになります。 冷却速度が速い場合には、純水は0℃になっても凝固する時間の余裕がなく、氷にならずに水のままで温度が0℃以下になります(こんどは点A’から点B’に進みます)。これを過冷却状態と言います。過冷却状態にある水のどこかに氷の結晶核が生成すると、もともとその水は氷になるべき不安定な状態にあるものですから、その結晶核を中心にしてなだれのように水から氷に変化します(点B’から点C’)。その際の凝固熱の発生速度は冷却速度よりも速く、温度が上昇します。どこまで温度が上昇するかと言うと、過冷却状態が解消されるまで、つまり0℃までです(点C’)。ですので、温度上昇は「都合よく」純水の凝固点0℃で止まることになります。 以上が、純水の場合でした。 水に何かが溶解して水溶液になっている場合も同様に説明できます。ですがその場合には、溶質による凝固点降下と、凝固に伴う水溶液の組成変化を考えなければなりません。 例えば、塩水を考えてみましょう。塩水は、塩が溶けている分だけ凝固点が0℃よりも下がっています。塩水をゆっくり冷却していくと、その水溶液固有の凝固点で氷になり始めます(点A)。氷は理想的には塩を含みませんので、氷になったぶんだけ残りの塩水から水が奪われ、残りの塩水の塩濃度が上がります。塩水の塩濃度が上がるとさらに凝固点が下がりますので、冷却を続けていくと、純水の場合の「0℃キープ」とは異なり、少しずつ温度が下がっていくことになります(点Aから点Cに進みます)。水が氷になっていく間は凝固点を維持する、という意味では純水の場合と同じなのですが、その凝固点が塩分濃度上昇のために下がっていくのです。その下がり具合が直線で近似できる理由は、凝固点降下が塩分濃度と比例関係にあること、さらに、水を奪われることによる塩分濃度上昇が時間とほぼ直線関係にあること、によりますが、これはあくまで近似です。 塩水で冷却速度が速い場合は、純水の場合と同様に考えてください。過冷却状態が解消されるのは、その時点での凝固点までです(点C)。そこからはゆっくり冷却した場合と同じように、直線的に温度が下がっていくことになります。以上のことから、冷却速度が速く、過冷却状態にした実験からも、直線関係を外挿して(点Cから点A)、あたかもゆっくり冷却した場合の凍り始めの温度(=冷却前の塩水の凝固点、点A)を見積もることができます。 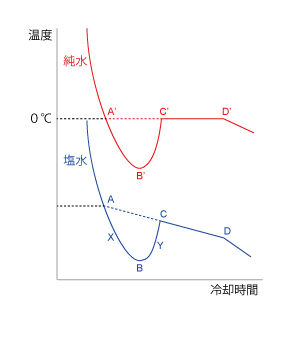 中高生の質問のページQ363の回答も考にしてください。 (NN) 2017/11/09 |
 |