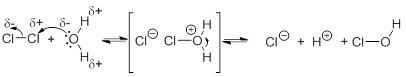
| Q369★ハロゲンと水の反応について教えてください。フッ素は酸素より酸化力が強いのでHFになれますが、塩素や臭素は自己酸化還元反応という特殊なことをします。この際、電子を奪うわけではないですが、水由来のHとOHとくっつきます。これはどういう仕組みなのでしょうか。また、ヨウ素は、酸化力が弱いため水には溶解しづらいと説明されますが、なぜ自己酸化還元反応という反応が起きないのでしょうか。 1つ目の質問は、臭素および塩素を水と反応させると自己酸化還元反応が進行し、水の酸化が起こらないのに、なぜHOBrやHOClには水由来の酸素とハロゲンとの結合が形成されるかですね。塩素の自己酸化還元反応を化学式で書くと以下のようになります。
塩素が関わる化学種のCl原子の酸化数を計算すると、Cl2は0、HOClは+1 、Cl-は?1になっています。このように、反応に水が関わっているものの、酸化還元自体はCl原子が担っているとみなせます。参考までに、反応機構は以下のような有機化学で用いる反応式で書けるかもしれません。 2つ目の質問は、ヨウ素ではなぜ自己酸化還元反応が進行しないのかですね。自己酸化還元反応は、上の塩素Cl2をハロゲン単体X2で一般化し、次のように表されます。
式1の平衡が右に傾いている場合、自己酸化還元反応が顕著になります。この傾きが何によって決められているのか考えてみましょう。式1を次の2つの式に分割します。 式2と式3を足すと式1になることを確かめてみてください。式2と式3のどちらかが(もしくは両方が)起こりやすければ、式1の平衡は右に傾きます。式2の進みやすさはCl > Br > Iの順です。これは、I2の酸化力(=自身の還元され易さ)が他の二つに比べて弱いことを意味します。一方、式3の進みやすさは、3つのハロゲンで式2ほどの違いはありません。そのために、式1の進みやすさは式2と同様にCl > Br > Iの順になり、I2の場合に低下することになります。その結果、ヨウ素の自己酸化還元反応はほとんど起こらないのです。 (YH & NN & MI) 2018/06/20 |
|||
 |