| Q380★教科書のコロイド溶液の作成や、この質問コーナーの回答の中においても、水酸化鉄(Ⅲ)Fe(OH)3という名前が出てきますが、本当は酸化水酸化鉄(Ⅲ)FeO(OH)のことを指しているのでしょうか? そうであれば、なぜそのように教えるのでしょうか? Fe(III)の水酸化物は安定物質? まず、水酸化鉄(Ⅲ) Fe(OH)3は確かに教科書等では良く出てくる物質ですが、実際にはそのような化合物が安定に存在するわけではありません。 1928年にDeissとSchikorrは、鉄の水中での腐食はFeの溶解によりFe(OH)2が形成され、充分な酸素の存在下ではFe(OH)3を経てα-FeOOHとなり、酸素が不十分だと緑サビを生成し、γ-FeOOHとなると報告しています[1]。また,1972年に佐藤は、Fe3+を含む水溶液では以下の反応が進行すると報告しています[2]。 Fe3+ → Fe(OH)2 + → FeOOH Fe2+を含む水溶液では、Fe2+が徐々に酸化された場合、pH 5~7では緑サビを生成し、最終的にγ-FeOOHになります。pH 8~9ではFe3O4になると考えられています[3]。緑サビとはFe2+とFe3+からなる準安定な中間生成物で、Fe(OH)3が含まれている場合もありますが、いずれにしてもFe(OH)3は安定に存在できる物質ではないと考えるのが妥当です。 Fe(III)の水酸化物がコロイドになる理由に触れながら… まず、コロイドになるということは、Fe(OH)3の単量体の状態ではなく、縮合反応が進行して、ナノメートルスケール以上のサイズで存在しているということです。その縮合プロセスを考えてみましょう。[4,5] Fe(III)は、基本的に6配位の八面体構造で、水中では6つのOH2(Aquo)が配位している状態です。[Fe(OH2)6]3+ ここで水の酸性度によっては、H3O+が抜け、OH(Hydroxo)が配位する、いわゆる加水分解反応が起こります。(図1および下記の式を参照) 図1 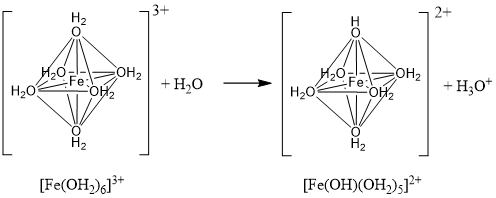 [Fe(OH2)6]3+ + H2O → [Fe(OH)(OH2)5]2+ + H3O+ ここで生成した(OH)と(OH2)が八面体の辺を共有する形で脱水縮合反応(-H2O)が起こると二量体化します。この二量体がさらなる縮合により発達し、例えばベルト状に並ぶと、沈殿物であるγ-FeOOH(レピドクロサイト)と呼ばれる結晶になります。これが水溶液中でのFeの水酸化物の縮合機構の一例です。(図2の機構参照) 図2 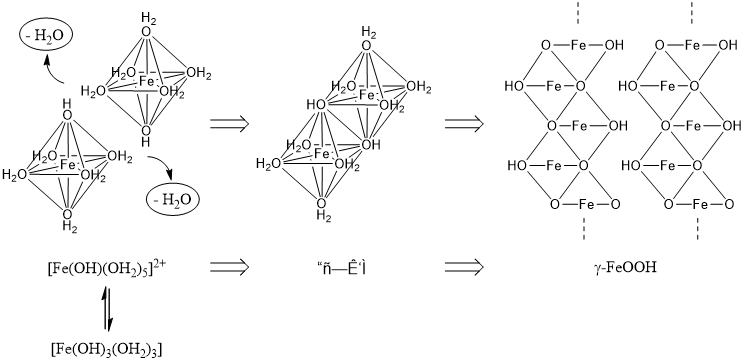 (pH等の反応条件によって、加水分解反応の進行度(=Hydroxoの数)や縮合サイトの反応性が変わるため、最終的な構造にも変化が生じますが、ここでは割愛(例えばα-FeOOHやβ-FeOOH等)。) 溶液中では、このような縮合反応を通じて、コロイドと呼ばれる粒子サイズまで発達したり、さらに八面体構造の向きを揃えながら縮合が進むとγ-FeOOHのように結晶として沈殿物が生じたりします。 ご質問のFe(OH)3のコロイドは、書き換えるとFe(OH)3(H2O)3と表すことができ、 実際の溶液中では、Fe(OH)3(H2O)3 ⇔ [Fe(OH)n(OH2)6-n](3-n)+の平衡状態で存在しています。 これらを出発原料(前駆体)として、縮合反応が進み、ナノサイズ以上に成長すると、コロイド粒子となるのです。縮合反応が進む際に、向きをそろえると 加水分解や縮合反応の条件により生成物の結晶系が異なることや、アモルファスの状態ではコロイドの組成も異なること等から、反応の理解が複雑であるため、教科書では割り切って”Fe(OH)3からなるコロイド”と言い切っているのではないでしょうか。 [参考文献] [1] E. Deiss, G. Schikorr, Z. Anorg. Aug. Chem., 172, 32 (1928) [2] 佐藤 教男, 防蝕技術, 21, 107 (1972) [3] 野村 貴美, 氏平 祐輔, Radioisotopes, 63, 531 (2014) [4] C. M. Flynn, Jr., “Hydrolysis of inorganic iron(III) salts”, Chem. Rev., 84 (1984) 31-41. [5] C. J. Brinker, W. S. George, “Sol-Gel Science: The Physics and Chemistry of Sol-Gel Processing”, Academic Press (1990). 高3 (KS & SM & SW) 2020/05/29 |
 |