| Q15★ダニエル電池で何故素焼き板を使うのですか?もし素焼き板がないとどうなるのですか?極での反応が進むにつれ亜鉛イオンと硫酸イオンが移動するなら何故銅イオンは移動しないのですか? ダニエル電池は正極外部回路に向かって正の電荷が流れ出す電極)を銅(元素記号でCu)、負極(外部回路から正の電荷が流れ込む電極)を亜鉛(Zn)とする電池です。これらの電極が酸化還元反応を起こして電圧を発生させるために、正極の銅の周囲に硫酸銅(正極活物質)の水溶液を、また、負極の亜鉛(負極活物質)の周囲に硫酸亜鉛の水溶液を配置します。電池の構造の一例を図1に示します。原理的には、硫酸銅の溶液と硫酸亜鉛の溶液が接していれば発電(放電)できます。しかし、硫酸銅の溶液と硫酸亜鉛の溶液の間に(セラミックス製の素焼きの板などの)仕切りが無いと、対流によって溶液が混ざってしまいます。これでは電池から効率良く電流を取り出すことができません。 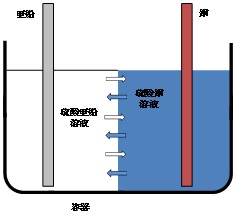 図1 ダニエル電池の構造と溶液の混合 そこで、対流による溶液の混合を防ぐために、硫酸銅の溶液と硫酸亜鉛の溶液の間に素焼きの板を使います。この時(放電前)の電池の構造は、図2のようになります。素焼きの板には小さな孔(貫通孔)が開いており、硫酸銅の溶液と硫酸亜鉛の溶液はこの孔の中で繋がっています。そのため、亜鉛イオン、硫酸イオンだけでなく、銅イオンもその繋がりを通して素焼きの板を通り抜けることができます。 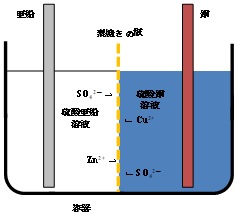 図2 素焼きの板を備えた電池におけるイオンの移動の可能性 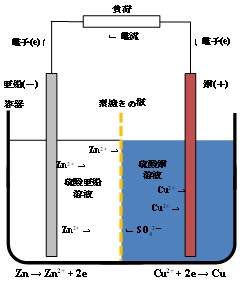 図3 電池の放電によるイオンの移動 電池が放電するとき、負極で亜鉛から亜鉛イオンと電子が生成します。 Zn → Zn2+ + 2e ― (1) 生成した電子は外部回路(負荷)を経て正極に向かい、正極で銅イオンと結合して銅を生成します。 Cu2+ + 2e → Cu ― (2) この過程における電荷の流れ(電流)に着目すると、外部回路では電子だけが電荷を運んでいますが、電池の内部では陽イオン(亜鉛イオンと銅イオン)と陰イオン(硫酸イオン)が電荷を分担して運びます。この時の電子やイオンの動きを図3に示します。陽イオンは負極から正極に向かって溶液の中を移動し、陰イオンは正極から負極に向かって移動します。このようなイオンの移動は、素焼きの板の孔の中でも起こります。 以上の説明は、電池の放電に伴うイオンの移動に関するものです。 Q38にもダニエル電池のことを書いてありますのでそちらもご覧ください。 (ST & SK) 2025/10/22修正(2016/02/10) |
 |