| Q38★Q-15にもありますが、素焼き板を通り過ぎるのが硫酸イオンと亜鉛イオンだけで、なぜ銅イオンが通り過ぎないのかを教えてください。硫酸銅水溶液の濃度を高くしておくと、浸透圧の関係で負極側に銅イオンが移動することはないのですか。 ダニエル電池の特徴と放電によるイオンの移動については、Q15で図1から図3を使って説明した通りですが、図2については再掲します。 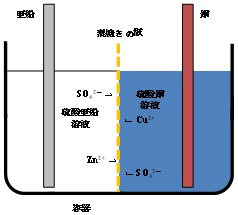 図2 素焼きの板を備えた電池におけるイオンの移動の可能性 ダニエル電池では、素焼きの板の小さな孔(貫通孔)の中で硫酸銅の溶液と硫酸亜鉛の溶液が接しています。素焼きの板は、硫酸銅の溶液と硫酸亜鉛の溶液の急激な混合を防ぎながら、硫酸亜鉛の溶液(ダニエル電池の電解質)と硫酸銅(ダニエル電池の減極材)の電気的な接触を得る工夫がされています。 次に、ダニエル電池におけるイオンの移動についてお答えします。ダニエル電池では、素焼きの板で硫酸銅の溶液と硫酸亜鉛の溶液の混合を防ぐ工夫がされていますが、電池の放電を行わない時(開回路状態の時)でも、厳密には両側で濃度の異なる銅イオン(化学記号でCu2+)、亜鉛イオン(Zn2+)、が素焼きの板の孔を通して僅かですが拡散によって移動します。すなわち、「銅イオンも通り過ぎます」というのがご質問に対する回答です。しかし、電池の放電を行っていないので、正イオンだけが移動するということはありません。電荷中性条件を満たすために、正イオンと同量の負イオン(この場合はSO42-)が移動します。ですから、見かけ上はZnSO4とCuSO4が動くことになります。 放電を行った場合、Zn電極からZn2+が酸化溶解することになりますが、これも硫酸亜鉛溶液の電荷中性条件を満たすためには、この溶液からZn2+が出て行くか、SO42-が入って来ることが必要となります。教科書にはそのことが説明されている訳です。上述したように放電しなくてもZnSO4が移動しているのですが、放電した場合はZnSO4の代わりにZn2+だけが移動すれば良いのです。あるいは、CuSO4の移動の代わりにSO42-が移動しても良いわけですが、もし硫酸亜鉛と硫酸銅の濃度が同じであるならば、SO42-の濃度は両側で同じなのでSO42-の拡散はほとんど起こらず、Zn2+の拡散が主となります。一方、硫酸銅の濃度が硫酸亜鉛より大きければ、SO42-の拡散も起こるでしょう。 以上のように、ダニエル電池の素焼き板には、亜鉛イオンも銅イオンも通り過ぎることができますが、銅イオンが硫酸イオンを伴って動くこと、つまり硫酸銅が正極側から負極側へ拡散することは、ダニエル電池の発電とは全く関係ありませんので、教科書の説明には書かれていません。だから、硫酸イオンと亜鉛イオンだけが動いているような図が書かれているのです。 また、このように説明すると、ダニエル電池はまるで電池として使ってない時も両イオンが動いてしまって、すごく使いにくそうな電池に感じますが、実はその通りです。素焼き板で仕切ったダニエル電池は、構造が簡単で余分な知識が必要無いので、高校の教科書等で取り上げられますが、実際に発電させて電流も取り出す実験をする時に使うことはありません。その場合は、イオン選択性高分子膜等の最新材料で両極側を仕切ったダニエル電池を使います。それについては、大学の物理化学の授業で習うことになります。 (ST & SK) 2025/10/22修正(2016/02/10) |
|
 |
|